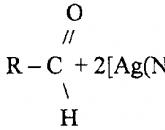Аминокислоты определяющие положительный заряд белков. Положительно заряженные аминокислоты
Аминокислоты классифицируются несколькими способами в зависимости от признака, по которому происходит их деление на группы. Принято в основном три классификации аминокислот: структурная - по строению бокового радикала; электрохимическая - за кислото-щелочными свойствами аминокислот; биологическая (физиологическая) - по мере незаменимости аминокислот для организма.
Согласно общей формулы a-аминокислоты отличаются только строением R, согласно чем они делятся на алифатические (ациклические), циклические (см. схему). Каждая группа подразделяется на подгруппы. Так, аминокислоты алифатического ряда в зависимости от количества амино-и карбоксильных групп делятся на моноаминомонокарбонови, диаминомонокарбонови, моноаминоды-карбоновые, диаминодикарбонови. Некоторые аминокислоты, уже входя в состав белков, могут модифицироваться, т.е. испытывать определенные химических превращений, которые приводят к изменению в структуре радикала. Они не принимают непосредственного участия в синтезе белков. Но их можно найти в гидролизате белков. Так, в результате процесса гидроксилирования, который происходит в организме, в боковые радикалы лизина и пролина белка коллагена вводятся ОН-группы с образованием гидроксилизину и гидроксипролина.
Этот процесс имеет место при взаимодействии цистеиновых остатков в полипептидной цепи: как внутри его, так и между полипептидными-ми цепями наблюдается при формировании пространственной конформации белковой молекулы.
По электрохимическими (кислотно-щелочными) свойствами аминокислоты зависимости от количества NH2-и СООН-групп в молекуле делятся на три группы: кислые - с дополнительными карбоксильными группами в боковом радикале (моноаминодикарбонови кислоты: аспарагиновая и глутаминовая) щелочные - диаминомонокарбонови (лизин, аргинин) и гистидин; нейтральные - остальные аминокислот, в которых боковой радикал не проявляет ни кислых, ни щелочных свойств. Некоторые авторы считают, что в цистеина и тирозина сульфгидрильных и гидроксильная группы в боковом радикале имеют слабо кислые свойства.
Современная рациональная классификация аминокислот основана на полярности радикалов, т.е. способности их к взаимодействию с водой при физиологических значениях рН (около рН 7,0). Она включает 4 класса аминокислот:
Неполярные (гидрофобные), боковые радикалы которых не имеют родства с водой. К ним относятся аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан, пролин;
Полярные (гидрофильные) незаряженные - глицин, серин, треонин, цистеин, тирозин, аспарагин, глутамин;
Полярные отрицательно заряженные - аспарагиновая и глутаминовая кислоты;
Полярные положительно заряженные - лизин, аргинин, гистидин.
По биологическим (физиологическим) значением аминокислоты подразделяют на три группы:
Незаменимые, которые не могут синтезироваться в организме из других соединений, поэтому должны обязательно поступать с пищевыми продуктами. Это незаменимые добавки пищи. Незаменимых аминокислот для человека восемь: трео-нин, метионин, валин, лейцин, изолейцин, лизин, фенилаланин и триптофан;
Напивзаминни аминокислоты могут образовываться в организме, но не в достаточном количестве, поэтому частично должны поступать с пищей. Для человека такими аминокислотами являются аргинин, тирозин, гистидин;
Заменимые аминокислоты синтезируются в организме в достаточном количестве из незаменимых аминокислот и других соединений. К ним относится остальные аминокислот. Приведенная биологическая классификация аминокислот не является универсальной в отличие от предыдущих и в определенной степени условна, так как зависит от вида организма. Однако абсолютное незаменимость восьми аминокислот является универсальной для всех видов организмов.
БИОЛОГИЧЕСКАЯ ХИМИЯ
Методический материал для самоподготовки)
Петрозаводск
ТЕМА 1. СТРОЕНИЕ, КЛАССИФИКАЦИЯ
И БИОЛОГИЧЕСКАЯ РОЛЬ АМИНОКИСЛОТ
Задание:
1. Выучить предложенный теоретический материал.
2. Ознакомиться с вариантами контрольной работы по теме.
(Выполнение контрольной работы по этой теме проводится на первом лабораторном занятии в 6-м семестре, во время летней сессии).
Аминокислотный состав белков
Историческая справка. Первая аминокислота – глицин была выделена в 1820 г. методом кислотного гидролиза желатины,полностью расшифрован аминокислотный состав белков в 1938 г., когда была идентифицирована последняя аминокислота – треонин (Имеются данные, что первым был выделен аспарагин из аспарагуса в 1806 г.).
Функции аминокислот. В настоящее время известно более 300 аминокислот, они могут выполнять разные функции:
· входят в состав всех белков – их 20, и такие аминокислоты называют стандартными, или протеиногенными ;
· входят в состав только редких, или определённых, белков (например, оксипролин, 5-оксилизин входят в состав коллагена; десмозин – в состав эластина);
· входят в состав других соединений (например, b-аланин входит в состав витамина В 3 , который необходим для синтеза КоА-SH);
· являются промежуточными метаболитами обменных процессов (например, орнитин, цитруллин);
· необходимы для синтеза биологически активных соединений, например, биогенных аминов, нейромедиаторов;
· необходимы для синтеза азотсодержащих соединений (полиаминов, нуклеотидов и нуклеиновых кислот);
· углеродный скелет аминокислот может использоваться для синтеза других соединений:
а) глюкозы – такие аминокислоты называются глюкогенными (большинство из протеиногенных);
б) липидов – кетогенными (вал, лей, иле, фен, тир);
· аминокислоты могут быть источником определенных функциональных групп – сульфатной (цистеин), одноуглеродных фрагментов (метионин, глицин и серин), аминогруппы (глутамин, аспарат).
Номенклатура аминокислот. Аминокислоты – производные карбо-новых кислот, в молекуле которых атом водорода у С, стоящего в a-положении, замещён аминогруппой. Общая формула L-изомеров аминокислот:
Отличаются аминокислоты между собой функциональными группами в боковой цепи (R). Каждая аминокислота имеет тривиальное, рациональное и сокращенное трех- или однобуквенное обозначение , например, глицин, аминоуксусная, гли.
Тривиальное название чаще всего связано с источником выделения или свойствами аминокислоты:
· серин входит в состав фиброина шелка (от лат. serius – шелковистый),
· тирозин впервые выделен из сыра (от греч. tyros – сыр),
· глутамин выделен из клейковины злаковых (от лат. gluten – клей),
· цистин – из камней мочевого пузыря (от греч. kystis – пузырь),
· аспарагиновая кислота – ростков спаржи (от лат. asparagus – спаржа),
· глицин от греч. glykos – сладкий.
Рациональное название складывается исходя из того, что каждая аминокислота является производной соответствующей карбоновой кислоты.
Сокращенное обозначение используют для написания аминокислотного состава и последовательности аминокислот в цепи. В биохимии чаще всего применяют тривиальное и сокращенное обозначение.
Классификация аминокислот.
Существует несколько классификаций:
1) по химической природе боковой цепи (R),
2) рациональная классификация (по степени полярности радикала, по Ленинджеру),
3) по способности синтезироваться в организме.
По химической природе боковой цепи (R) все аминокислоты делятся на:
Ациклические (алифатические):
· моноаминомонокарбоновые
· моноаминодикарбоновые
· диаминомонокарбоновые
· диаминодикарбоновые
Циклические:
1) гомоциклические (фен, тир);
2) гетероциклические :
· аминокислоты (гис, три);
· иминокислоты (про).
По Ленинджеру (по способности радикала взаимодействовать с водой) все аминокислоты делят на 4 группы:
· неполярные , незаряженные (гидрофобные ) – их 8: ала, вал, лей, иле, мет, фен, три, про;
· полярные , незаряженные (гидрофильные ) – их 7: сер, тре, глн, асн, цис, тир, гли;
· отрицательно-заряженные – их 2: асп, глу;
· положительно-заряженные – их 3: гис, арг, лиз.
По способности синтезироваться в организме аминокислоты могут быть:
· заменимыми , которые могут синтезироваться в организме;
· незаменимыми , которые не могут синтезироваться в орга-низме и должны поступать с пищей.
Понятие «незаменимые» относительно для каждого вида – у человека и свиней их 10 (вал, лей, иле, тре, мет, фен, три, арг, гис, лиз), у животных с четырехкамерным желудком – 2 серосодержащие (цис, мет), у птиц – 1 (гли).
Физико-химические свойства аминокислот:
1. Растворимы в воде (лучше растворимы положительно- и отрицательно заряженные аминокислоты, затем гидрофиль-ные, хуже – гидрофобные).
2. Имеют высокую точку плавления (обусловлено тем, что в кристаллическом виде находятся в виде биполярных ионов).
3. Обладают оптической активностью, которая обусловлена наличием асимметрического атома углерода(за исключением гли). В связи с этим аминокислоты:
· существуют в виде L- и D-стереоизомеров, но в состав белков высших животных входят в основном аминокислоты L-ряда; количество стереоизомеров зависит от количестваасимметрических атомов углерода и рассчитывается по формуле 2 n , где n – количество асимметрических атомов С;
· способны вращать плоскость поляризованного света вправо или влево; величина удельного вращения у разных аминокислот варьирует от 10 до 30 º .
4. Амфотерные свойства (аминокислоты, кроме гли, при физиологических значениях рН и в кристаллическом виде находятся в виде биполярных ионов). Величина рН, при которой суммарный заряд аминокислоты равен 0, называется изоэлектрической точкой. Для моноаминомонокарбоновых аминокислот она лежит в интервале 5,5-6,3, диаминомоно-карбоновых – больше 7, для дикарбоновых – меньше 7.
5. Химические свойства :
· кислотные свойства, обусловленные наличием карбоксильной группы;
· основные свойства, обусловленные наличием аминогруппы;
· свойства, обусловленные взаимодействием амино-
и карбоксильной групп между собой;
· свойства, обусловленные наличием функциональных групп в боковой цепи.
Аминокисло́ты (аминокарбо́новые кисло́ты; АМК ) - органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот это углерод (C), водород (H), кислород (O), и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известны около 500 встречающихся в природе аминокислот. Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.
| Аминокислота | Аббревиатура | Способность организма к синтезу | Характер катаболизма | мнемоническое правило | Полярность | Углеводородный радикал | Класс | Пути синтеза, семейство | Генетический код | Mr | Vw (Å3) | pI | шкала гидрофобности | частота в белках (%) | Год открытия | Источник | Впервые выделен |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Аланин | Ala, A | заменимая | глюкогенная | Alanine | Неполярные | 2 | пируват | GCU, GCC, GCA, GCG | 89.094 | 67 | 6.01 | 1.8 | 8.76 | 1888 | Фиброин шелка | А. Штреккер, Т. Вейль | |
| Аргинин | Arg, R | глюкогенная | aRginine | Полярные | заряженные положительно | 1 | глутамат | CGU, CGC, CGA, CGG, AGA, AGG | 174.203 | 148 | 10.76 | −4.5 | 5.78 | 1895 | Вещество рога | С. Гедин | |
| Аспарагин | Asn, N | заменимая | глюкогенная | asparagiNe | Полярные | незаряженные амиды | 2 | аспартат | AAU, AAC | 132.119 | 96 | 5.41 | −3.5 | 3.93 | 1806 | Сок спаржи | Л.-Н. Воклен и П. Ж. Робике |
| Аспарагиновая, аспартат | Asp, D | заменимая | глюкогенная | asparDic acid | Полярные | заряженные отрицательно | 2 | аспартат | GAU, GAC | 133.104 | 91 | 2.85 | −3.5 | 5.49 | 1868 | Конглутин, легумин (ростки спаржи) | Г. Риттхаузен |
| Валин | Val, V | незаменимая | глюкогенная | Valine | Неполярные | нейтральные гидрофобные алифатические | 1 | пируват | GUU, GUC, GUA, GUG | 117.148 | 105 | 6.00 | 4.2 | 6.73 | 1901 | Казеин | Э. Фишер |
| Гидроксилизин | Hyl, hK | заменимая | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1925 | Белки рыб | С. Шрайвер и др. | |
| Гидроксипролин | Hyp, hP | заменимая | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1902 | Желатин | Э. Фишер | |
| Гистидин | His, H | заменимая условно незаменимая | глюкогенная | Histidine | Полярные | заряженные положительно гетероциклические | 2 | пентоз | CAU, CAC | 155.156 | 118 | 7.60 | −3.2 | 2.26 | 1896 | Стурин, гистоны | А. Коссель , С. Гедин |
| Глицин | Gly, G | заменимая | глюкогенная | Glycine | Неполярные | незаряженные R-группа алифатические | 2 | серин | GGU, GGC, GGA, GGG | 75.067 | 48 | 6.06 | −0.4 | 7.03 | 1820 | Желатин | А. Браконно |
| Глутамин | Gln, Q | заменимая | глюкогенная | Q-tamine | Полярные | незаряженные амиды | 1 | глутамат | CAA, CAG | 146.146 | 114 | 5.65 | −3.5 | 3.9 | 0 | 0 | 0 |
| Глутаминовая, глутамат | Glu, E | заменимая | глюкогенная | gluEtamic acid | Полярные | заряженные отрицательно | 1 | глутамат | GAA, GAG | 147.131 | 109 | 3.15 | −3.5 | 6.32 | 1866 | Растительные белки | Г. Риттхаузен |
| Изолейцин | Ile, I | незаменимая | глюко-кетогенная | Isoleucine | Неполярные | нейтральные гидрофобные алифатические | 1 | аспартат | AUU, AUC, AUA | 131.175 | 124 | 6.05 | 4.5 | 5.49 | 1904 | Фибрин | Ф. Эрлих |
| Лейцин | Leu, L | незаменимая | кетогенная | Leucine | Неполярные | нейтральные гидрофобные алифатические | 1 | пируват | UUA, UUG, CUU, CUC, CUA, CUG | 131.175 | 124 | 6.01 | 3.8 | 9.68 | 1820 | Мышечные волокна | А. Браконно |
| Лизин | Lys, K | незаменимая | кетогенная | before L | Полярные | заряженные положительно | 07.08.1900 | аспартат | AAA, AAG | 146.189 | 135 | 9.60 | −3.9 | 5.19 | 1889 | Казеин | Э. Дрексель |
| Метионин | Met, M | незаменимая | глюкогенная | Methionine | Неполярные | нейтральные гидрофобные серосодержащие | 1 | аспартат | AUG | 149.208 | 124 | 5.74 | 1.9 | 2.32 | 1922 | Казеин | Д. Мёллер |
| Пролин | Pro, P | заменимая | глюкогенная | Proline | Неполярные | нейтральные гидрофобные гетероциклические | 2 | глутамат | CCU, CCC, CCA, CCG | 115.132 | 90 | 6.30 | −1.6 | 5.02 | 1901 | Казеин | Э. Фишер |
| Серин | Ser, S | заменимая | глюкогенная | Serine | Полярные | 2 | серин | UCU, UCC, UCA, UCG, AGU, AGC | 105.093 | 73 | 5.68 | −0.8 | 7.14 | 1865 | Шёлк | Э. Крамер | |
| Тирозин | Tyr, Y | заменимая | глюко-кетогенная | tYrosine | Полярные | незаряженные ОН-группа ароматические | 1 | пентоз | UAU, UAC | 181.191 | 141 | 5.64 | −1.3 | 2.91 | 1848 | Казеин | Ю. фон Либих |
| Треонин | Thr, T | незаменимая | глюкогенная | Threonine | Полярные | незаряженные ОН-группа оксимоноаминокарбоновые | 2 | аспартат | ACU, ACC, ACA, ACG | 119.119 | 93 | 5.60 | −0.7 | 5.53 | 1925 | Белки овса | С. Шрайвер и др. |
| Триптофан | Trp, W | незаменимая | глюко-кетогенная | tWo rings | Неполярные | 1 | пентоз | UGG | 204.228 | 163 | 5.89 | −0.9 | 6.73 | 1902 | Казеин | Ф. Хопкинс, Д. Кол | |
| Фенилаланин | Phe, F | незаменимая | глюко-кетогенная | Fenylalanine | Неполярные | нейтральные гидрофобные ароматические | 2 | пентоз | UUU, UUC | 165.192 | 135 | 5.49 | 2.8 | 3.87 | 1881 | Ростки люпина | Э. Шульце, Й. Барбьери |
| Цистеин | Cys, C | заменимая | глюкогенная | Cysteine | Полярные | незаряженные HS-группа серосодержащие | 1 | серин | UGU, UGC | 121.154 | 86 | 5.05 | 2.5 | 1.38 | 1899 | Вещество рога | К. Мёрнер |
Аминокислоты классифицируют по следующим структурным признакам.
I . Классификация по взаимному положения функциональных групп
В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α- , b- , g- , d- , e- и т. д.
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы.
II . Классификация по строению бокового радикала (функциональным группам)
Алифатические аминокислоты
Моноаминомонокарбоновые кислоты : глицин, аланин, валин, изолейцин, лейцин.
Оксимоноаминокарбоновые кислоты (содержат-ОН-группу): серин, треонин.
Моноаминодикарбоновые кислоты (содержат СООН-группу): аспартат, глутамат (за счёт второй карбоксильной группы несут в растворе отрицательный заряд).
Амиды моноаминодикарбоновых кислоты (содержат NH 2 СО-группу): аспарагин, глутамин.
Диаминомонокарбоновые кислоты (содержат NH 2 -группу): лизин, аргинин (за счёт второй аминогруппы несут в растворе положительный заряд).
Ароматические аминокислоты : фенилаланин, тирозин, триптофан.
Гетероциклические аминокислоты : триптофан, гистидин, пролин.
Иминокислоты аминокислоты : пролин.
Важнейшие α–аминокислоты
III . Классификация по полярности бокового радикала (R-групп)
Выделяют четыре класса аминокислот, содержащих радикалы следующих типов.
Гидрофобные аминокислоты располагаются внутри молекулы белка, тогда как гидрофильные – на внешней поверхности, что делает гидрофильными и хорошо растворимыми в воде молекулы белка.
Благодаря этому свойству белки хорошо связывают воду, удерживая жидкость в крови, в межклеточном пространстве и внутри клеток.
1. Неполярные (гидрофобные)
К неполярным (гидрофобным) относятся аминокислоты с неполярными R-группами и одна серосодержащая аминокислота:
Алифатические: аланин, валин, лейцин, изолейцин
Ароматические: фенилаланин, триптофан.
Иминокислота: пролин.
2. Полярные незаряженные
Полярные незаряженные аминокислоты по сравнению с неполярными лучше растворяются в воде, более гидрофильны, так как их функциональные группы образуют водородные связи с молекулами воды.
К ним относятся аминокислоты, содержащие:
Полярную ОН-группу (оксиаминокислоты): серин, треонин и тирозин
HS-группу: цистеин
Амидную группу: глутамин, аспарагин
И глицин (R-группа глицина, представленная одним атомом водорода, слишком мала, чтобы компенсировать сильную полярность a-аминогруппы и a-карбоксильной группы).
3. Заряженные отрицательно при рН-7 (кислые)
Аспарагиновая и глутаминовая кислоты относятся к отрицательно заряженным аминокислотам.
4. Заряженные положительно при рН-7 (основные)
К положительно заряженным аминокислотам принадлежат лизин, гистидин и аргинин .
В ионизированном виде они имеют суммарный положительный заряд:
В зависимости от характера радикалов природные аминокислоты также подразделяются на нейтральные, кислые и основные . К нейтральным относятся неполярные и полярные незаряженные, к кислым – отрицательно заряженные, к основным – положительно заряженные.
IV . Классификация по кислотно-основным свойствам
В зависимости от количества функциональных групп различают кислые, нейтральные и основные аминокислоты.
Основные
Аминокислоты, в которых число аминогрупп превышает число карбоксильных групп, называют основными аминокислотами: лизин, аргинин, гистидин:
Кислые
Если в аминокислотах имеется избыток кислотных групп, их называют кислыми аминокислотами: аспарагиновая и глутаминовая кислоты:
Все остальные аминокислоты относятся к нейтральным.
V . По числу функциональных групп
Аминокислоты по числу функциональных групп можно разделить моноаминомонокарбоновые, моноаминодикарбоновые, диаминомонокарбоновые:
V I . Биологическая классификация (по способности синтезироваться в организме человека и животных)
Заменимые аминокислоты – десять из 20 аминокислот, входящих в состав белков, могут синтезироваться в организме человека. К ним относятся: глицин (гликокол), аланин, серин, цистеин, тирозин, аспарагиновая и глутаминовая кислоты, аспарагин, глутамин, пролин.
Незаменимые аминокислоты (8 аминокислот) – не могут синтезироваться в организме человека и животных и должны поступать в организм в составе белковой пищи.
Абсолютно незаменимых аминокислот восемь: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
Незаменимые аминокислоты входят часто в состав пищевых добавок, используются в качестве лекарственных препаратов.
Условно незаменимые (2 аминокислоты) - синтезируются в организме, но в недостаточном количестве, поэтому частично должны поступать с пищей. Такими аминокислотами являются гистидин, аргинин.
Для детей также незаменимыми являются гистидин и аргинин.
Для человека одинаково важны оба типа аминокислот: и заменимые, и незаменимые. Большая часть аминокислот идет на построение собственных белков организма, но без незаменимых аминокислот организм существовать не сможет.
При недостатке каких-либо аминокислот в организме человека в течение непродолжительного времени могут разрушаться белки соединительной ткани, крови, печени и мышц, а полученный из них «строительный материал» - аминокислоты идут на поддержание нормальной работы наиболее важных органов - сердца и мозга.
Дефицит аминокислот приводит к ухудшению аппетита, задержке роста и развития, жировой дистрофии печени и другим тяжелым нарушениям.
При этом наблюдается снижение аппетита, ухудшение состояния кожи, выпадение волос, мышечная слабость, быстрая утомляемость, снижение иммунитета, анемия.
Избыток аминокислот может вызвать развитие тяжелых заболеваний, особенно у детей и в юношеском возрасте. Наиболее токсичными являются метионин (провоцирует риск развития инфаркта и инсульта), тирозин (может спровоцировать развитие артериальной гипертонии, привести к нарушению работы щитовидной железы) и гистидин (может способствовать возникновению дефицита меди в организме и привести к заболеваниям суставов, ранней седине, тяжелым анемиям).
В условиях нормального функционирования организма, когда присутствует достаточное количество витаминов (В 6 , В 12 , фолиевой кислоты) и антиоксидантов (витамины А, Е, С и селен), избыток аминокислот не наносит вред организму.
VII. По характеру катаболизма у животных
Биодеградация аминокислот может идти разными путями.
По характеру продуктов катаболизма у животных протеиногенные аминокислоты делят на три группы:
- Глюкогенные - при распаде дают метаболиты, не повышающие уровень кетоновых тел, способные относительно легко становиться субстратом для глюконеогенеза: пируват, α-кетоглутарат, сукцинил-KoA, фумарат, оксалоацетат
- Кетогенные - распадаются до ацетил-KoA и ацетоацетил-KoA, повышающие уровень кетоновых тел в крови животных и человека и преобразующиеся в первую очередь в липиды
- Глюко-кетогенные - при распаде образуются метаболиты обоих типов
Кетеновое тело — ацетон, ацетоноуксусная кислота
Лекция №3Тема: «Аминокислоты – строение, классификация, свойства, биологическая роль»
Аминокислоты – азотосодержащие органические соединения, в молекулах которых содержатся аминогруппа –NH2 и карбоксильная группа -СООН
Простейшим представителем является аминоэтановая кислота H2N - CH2 - COOH
Классификация аминокислот
Существует 3 основные классификации аминокислот:
Физико-химическая – основана на различиях в физико-химических свойствах аминокислот
Гидрофобные аминокислоты (неполярные). Компоненты радикалов содержат обычно углеводородные группы, где равномерно распределена электронная плотность и нет никаких зарядов и полюсов. В их составе могут присутствовать и электроотрицательные элементы, но все они находятся в углеводородном окружении .
Гидрофильные незаряженные (полярные) аминокислоты . Радикалы таких аминокислот содержат в своем составе полярные группировки: -ОН, - SH, -CONH2
Отрицательно заряженные аминокислоты . Сюда относятся аспарагиновая и глутаминовая кислоты. Имеют дополнительную СООН-группу в радикале - в нейтральной среде приобретают отрицательный заряд.
Положительно заряженные аминокислоты : аргинин, лизин и гистидин. Имеют дополнительную NH 2 -группу (или имидазольное кольцо, как гистидин) в радикале - в нейтральной среде приобретают положительный заряд.
Незаменимые аминокислоты, их еще называют "эссенциальные". Они не могут синтезироваться в организме человека и должны обязательно поступать с пищей. Их 8 и еще 2 аминокислоты относятся к частично незаменимым.
Частично незаменимые : аргинин, гистидин.
Заменимые (могут синтезироваться в организме человека). Их 10: глутаминовая кислота, глутамин, пролин, аланин, аспарагиновая кислота, аспарагин, тирозин, цистеин, серин и глицин.
Аминокислоты классифицируют по структурным признакам.
1. В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α-, β-, γ-, δ-, ε- и т. д.

Потребность в аминокислотах снижается:
При врожденных нарушениях, связанных с усваиваемостью аминокислот. В этом случае , некоторые белковые вещества могут стать причиной аллергических реакций организма, включая появление проблем в работе желудочно-кишечного тракта, зуд
и тошноту.
Усваиваемость аминокислот
Скорость и полнота усвоения аминокислот зависит от типа продуктов, их содержащих. Хорошо усваиваются организмом аминокислоты, содержащиеся в белке яиц, обезжиренном твороге, нежирном мясе и рыбе.
Быстро усваиваются также аминокислоты при правильном сочетании продуктов: молоко сочетается с гречневой кашей
и белым хлебом, всевозможные мучные изделия с мясом и творогом .
Полезные свойства аминокислот, их влияние на организм
Каждая аминокислота оказывает на организм свое воздействие. Так метионин особенно важен для улучшения жирового обмена в организме, используется как профилактика атеросклероза, при циррозе и жировой дистрофии печени.
При определенных нервно-психических заболеваниях используется глутамин, аминомасляные кислоты. Глутаминовая кислота также применяется в кулинарии как вкусовая добавка. Цистеин показан при глазных заболеваниях.
Три главные аминокислоты – триптофан, лизин и метионин, особенно необходимы нашему организму. Триптофан используется для ускорения роста и развития организма, также он поддерживает азотистое равновесие в организме.
Лизин обеспечивает нормальный рост организма, участвует в процессах кровеобразования .
Основные источники лизина и метионина – творог, говядина, некоторые виды рыбы (треска, судак, сельдь). Триптофан встречается в оптимальных количествах в субпродуктах, телятине и дичи.инфаркта.
Аминокислоты для здоровья, энергичности и красоты
Для успешного наращивания мышечной массы в бодибилдинге нередко используются аминокислотные комплексы, состоящие из лейцина изолейцина и валина.
Для сохранения энергичности во время тренировок спортсмены в качестве добавок к питанию используют метионин, глицин и аргинин, или продукты, их содержащие.
Для любого человека, ведущего активный здоровый образ жизни, необходимы специальные продукты питания, которые содержат ряд необходимых аминокислот для поддержания отличной физической формы, быстрого восстановления сил, сжигания лишних жиров или наращивания мышечной массы.
Общая характеристика (строение, классификация, номенклатура, изомерия).
Основной структурной единицей белков являются a-аминокислоты. В природе встречается примерно 300 аминокислот. В составе белков найдено 20 различных a-аминокислот (одна из них – пролин, является не амино -, а имино кислотой). Все другие аминокислоты существуют в свободном состоянии или в составе коротких пептидов, или комплексов с другими органическими веществами.
a-Аминокислоты представляют собой производные карбоновых кислот, у которых один водородный атом, у a-углеродного атома замещен на аминогруппу (–NН 2), например:
Различаются аминокислоты по строению и свойствам радикала R. Радикал может представлять остатки жирных кислот, ароматические кольца, гетероциклы. Благодаря этому каждая аминокислота наделена специфическими свойствами, определяющими химические, физические свойства и физиологические функции белков в организме.
Именно благодаря радикалам аминокислот, белки обладают рядом уникальных функций, не свойственных другим биополимером, и обладают химической индивидуальностью.
Значительно реже в живых организмах встречаются аминокислоты с b- или g-положением аминогруппы, например:
Классификация и номенклатура аминокислот.
Существует несколько видов классификаций аминокислот входящих в состав белка.
А) В основу одной из классификаций положено химическое строение радикалов аминокислот. Различают аминокислоты:
1. Алифатические – глицин, аланин, валин, лейцин, изолейцин:

2. Гидроксилсодержащие – серин, треонин:


4. Ароматические – фенилаланин, тирозин, триптофан:
 5. С анионобразующими группами в боковых цепях-аспарагиновая и глутаминовая кислоты:
5. С анионобразующими группами в боковых цепях-аспарагиновая и глутаминовая кислоты:

6. и амиды-аспарагиновой и глутаминовой кислот – аспарагин, глутамин.

7. Основные – аргинин, гистидин, лизин.
 8. Иминокислота – пролин
8. Иминокислота – пролин
 |
Б) Второй вид классификации основан на полярности R-групп аминокислот.
Различают полярные и неполярные аминокислоты. У неполярных в радикале есть неполярные связи С–С, С–Н, таких аминокислот восемь: аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан, пролин.
Все остальные аминокислоты относятся к полярным (в R-группе есть полярные связи С–О, С–N, –ОН, S–H). Чем больше в белке аминокислот с полярными группами, тем выше его реакционная способность. От реакционной способности во многом зависят функции белка. Особенно большим числом полярных групп, характеризуются ферменты. И наоборот, их очень мало в таком белке как кератин (волосы, ногти).
В) Аминокислоты классифицируют и на основе ионных свойств R-групп (таблица 1).
Кислые (при рН=7 R-группа может нести отрицательный заряд) это аспарагиновая, глутаминовая кислоты, цистеин и тирозин.
Основные (при рН=7 R-группа может нести положительный заряд) – это аргинин, лизин, гистидин.
Все остальные аминокислоты относятся к нейтральным (группа R незаряжена).
Таблица 1 – Классификация аминокислот на основе полярности
R-групп.
R-группы
Аспарагиновая к-та
Глутаминовая к-та
4. Положительно заряженные
R-группы
Гистидин
Г) По числу аминных и карбоксильных групп аминокислоты делятся:
– на моноаминамонокарбоновые , содержащие по одной карбоксильной и аминной группе;
– моноаминодикарбоновые (две карбоксильные и одна аминная группа);
– диаминомонокарбоновые (две аминные и одна карбоксильная группа).
Д) По способности синтезироваться в организме человека и животных все аминокислоты делятся:
– на заменимые,
– незаменимые,
– частично незаменимые .
Незаменимые аминокислоты не могут синтезироваться в организме человека и животных они обязательно должны поступать вместе с пищей. Абсолютно незаменимых аминокислот восемь: валин, лейцин,изолейцин,треонин,триптофан, метионин,лизин, фенилаланин.
Частично незаменимые - синтезируются в организме, но в недостаточном количестве, поэтому частично должны поступать с пищей. Такими аминокислотами являются арганин, гистидин, тирозин.
Заменимые аминокислоты синтезируются в организме человека в достаточном количестве из других соединений. Растения могут синтезировать все аминокислоты.
Изомерия
В молекулах всех природных аминокислот (за исключением глицина) у a-углеродного атома все четыре валентные связи заняты различными заместителями, такой атом углерода является асимметрическим, и получил название хирального атома . Вследствие этого растворы аминокислот обладают оптической активностью – вращают плоскость плоскополяризованного света. Число возможных стереоизомеров ровно 2 n , где n – число асимметрических атомов углерода. У глицина n = 0, у треонина n = 2. Все остальные 17 белковых аминокислот содержат по одному асимметрическому атому углерода, они могут существовать в виде двух оптических изомеров.
В качестве стандарта при определении L и D -конфигураций аминокислот используется конфигурация стереоизомеров глицеринового альдегида.
Расположение в проекционной формуле Фишера NH 2 -группы слева соответствуют L -конфигурации, а справа – D -конфигурации.

Следует отметить, что буквы L и D означают принадлежность того или иного вещества по своей стереохимической конфигурации к L или D ряду, независимо от направленности вращения.
Кроме 20 стандартных аминокислот встречающихся почти во всех белках, существуют еще нестандартные аминокислоты, являющиеся компонентами лишь некоторых типов белков – эти аминокислоты называют еще модифицированными (гидроксипролин и гидроксилизин).
Методы получения
– Аминокислоты имеют чрезвычайно большое физиологическое значение. Из остатков аминокислот построены белки и полипептиды.
При гидролизе белковых веществ животных и растительных организмов образуются аминокислоты.
Синтетические способы получения аминокислот:
– Действие аммиака на галоидзамещённые кислоты

– α-Аминокислоты получают действием аммиака на оксинит-рилы
Популярное
- Раздел презентации на тему твардовский
- Самые дельные советы по изучению английского языка самостоятельно Как учить алфавит
- Концепция подражания г, тарда Габриэль Тард и его социальная теория
- Человек разумный (homo sapiens)
- Как развить в себе магические способности
- Краткая биография и дети Чингисхана
- Первый ледокол ермак. Ледокол ермак. Долгая служба ледокола «Ермак»
- Француженок, которые "водились" с немцами брили наголо (11 фото)
- Необходимый перечень документов на лицензию образовательной деятельности
- Расцвет империи моголов. Загадочный падишах. акбар великий Религиозная реформа Акбара