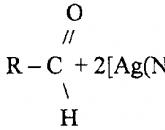Применение альдегидов и кетонов таблица. Альдегиды и кетоны: формула и химические свойства, получение, применение
Органические ЛС
Мы изучаем ЛС, поделенные на группы в соответствии с химической классификацией. Достоинством этой классификации является возможность выявления и исследования общих закономерностей при разработке методов получения препаратов, составляющих группу, методов фармацевтического анализа, основанных на физических и химических свойствах веществ, установления связи между химической структурой и фармакологическим действием.
Все ЛВ делятся на неорганические и органические. Неорганические, в свою очередь, классифицируются в соответствии с положением элементов в ПС. А органические – делятся на производные алифатического, алициклического, ароматического и гетероциклического ряда, каждый из которых подразделяется по классам: углеводороды, галогенпроизводные углеводородов, спирты, альдегиды, кетоны, кислоты, эфиры простые и сложные и т.д.
АЛИФАТИЧЕСКИЕ СОЕДИНЕНИЯ, КАК ЛС.
Препараты альдегидов и их производных. Углеводы
Альдегиды
К этой группе соединений относятся органические лекарственные вещества, содержащие альдегидную группу, или их функциональные производные.
Общая формула:
Фармакологические свойства
Введение альдегидной группы в структуру органического соединения сообщает ему наркотическое и антисептическое действие. В этом действие альдегидов сходно с действием спиртов. Но в отличие от спиртовой, альдегидная группа усиливает токсичность соединения.
Факторы влияния строения на фармакологическое действие :
удлинение алкильного радикала повышает активность, но одновременно растет токсичность;
такой же эффект имеет введение непредельной связи и галогенов;
к снижению токсичности приводит образование гидратной формы альдегида. Но способность к образованию устойчивой гидратной формы проявляется только у хлорпроизводных альдегидов. Так, формальдегид является протоплазматическим ядом, используется для дезинфекции, уксусный альдегид и хлораль не применяются в медицине из-за высокой токсичности, а хлоралгидрат – ЛС, применяется как снотворное, успокоительное.
Сила наркотического (фармакологического) действия и токсичность росли от формальдегида к ацетальдегиду и хлоралю. Образование гидратной формы (хлоралгидрат) позволяет резко снизить токсичность, сохранив фармакологический эффект.
По физическому состоянию альдегиды могут быть газообразными (низкомолекулярные), жидкостями и твердыми веществами . Низкомолекулярные имеют резкий неприятный запах, высокомолекулярные – приятный цветочный.
Химические свойства
В химическом отношении это высоко реакционноспособные вещества, что обусловлено наличием в их молекуле карбонильной группы.
Высокая реакционная способность альдегидов объясняется:
а) наличием поляризованной двойной связи
б) дипольным моментом карбонила
в) наличием частичного положительного заряда на атоме углерода карбонила
σ -
σ + H
Двойная связь между С и О, в отличие от двойной связи между двумя углеродами, сильно поляризована, так как кислород обладает значительно большей электроотрицательностью, чем углерод, и электронная плотность π-связи смещается к кислороду. Такая высокая поляризация определяет электрофильные свойства углерода карбонильной группы и его способность реагировать с нуклеофильными соединениями (вступать в реакции нуклеофильного присоединения). Кислород группы обладает нуклеофильными свойствами.
Характерны реакции окисления и нуклеофильного присоединения
I. Реакции окисления.
Альдегиды легко окисляются . Окисление альдегидов до кислот происходит под влиянием как сильных, так и слабых окислителей .
Многие металлы – серебро, ртуть, висмут, медь, восстанавливаются из растворов их солей, особенно в присутствии щелочи. Это отличает альдегиды от других органических соединений, способных к окислению – спиртов, непредельных соединений, для окисления которых необходимы более сильные окислители. Следовательно, реакции окисления альдегидов комплексно связанными катионами ртути, меди, серебра в щелочной среде можно применять для доказательства подлинности альдегидов.
I. 1 .Реакция с аммиачным раствором нитрата серебра (реакция серебряного зеркала) рекомендуется ФС для подтверждения подлинности веществ с альдегидной группой.В основе окисление альдегида до кислоты и восстановление Ag + до Ag↓.
AgNO 3 + 2NH 4 OH → NO 3 +2H 2 O
НСОН + 2NO 3 + H 2 O → HCOONH 4 + 2Ag↓+ 2NH 4 NO 3 + NH 3
Формальдегид, окисляясь до аммонийной соли муравьиной кислоты, восстанавливает до металлического серебро, которое осаждается на стенках пробирки в виде блестящего налета «зеркала» или серого осадка.

I. 2. Реакция с реактивом Фелинга (комплексное соединение меди (II) с калий-натриевой солью винной кислоты). Альдегиды восстанавливают соединение меди (II) до оксида меди (I), образуется кирпично-красный осадок. Готовят перед употреблением).
реактив Феллинга 1 - раствор CuSO 4
реактив Феллинга 2 – щелочной раствор калий-натриевой соли винной кислоты
При смешавании 1:1 реактивов Феллинга 1 и 2 образуется синее комплексное соединение меди (II ) с калий-натриевой солью винной кислоты:

синее окрашивание
При добавлении альдегида и нагревании синее окрашивание реактива исчезает, образуется промежуточный продукт - желтый осадок гидроксида меди (I), сразу разлагающийся на красный осадок оксида меди (I) и воду.
2KNa +R - COH +2NaOH+ 2KOH→R - COONa +4KNaC 4 H 4 O 6 +2 CuOH ↓ +H 2 O
2 CuOH ↓ →Cu 2 O ↓ + H 2 O
Желтый осадок кирпично-красный осадок

В учебниках иная общая схема реакции
I. 3. Реакция с реактивом Несслера (щелочной раствор тетрайодмеркурат (II) калия). Формальдегид восстанавливает ион ртути до металлической ртути – осадок темно-серого цвета.
R-COH + K 2 +3KOH → R-COOK + 4KI + Hg ↓ + 2H 2 O
1. Р. Окисления.
Альдегиды легко окисляются до карбоновых кислот. Окислителями могут служить гидроксид меди (II), оксид серебра, кислород воздуха:
Ароматические альдегиды окисляются труднее алифатических. Кетоны, как было сказано выше, окисляются труднее альдегидов. Окисление кетонов проводится в жестких условиях, в присутствии сильных окислителей. Образуются в результате смеси карбоновых кислот. Как отличить альдегиды от кетонов? Различие в способности к окислению служит основой качественных реакций, позволяющих отличить альдегиды от кетонов. Многие мягкие окислители легко реагируют с альдегидами, но инертны по отношению к кетонам. а) Реактив Толленса (аммиачный раствор оксида серебра), содержащий комплексные ионы +, дает с альдегидами реакцию «серебряного зеркала». При этом образуется металлическое серебро. Раствор оксида серебра готовят непо средственно пере д опытом:
Реактив Толленса окисляет альдегиды до соответствующих карбоновых кислот, которые в присутствии аммиака образуют аммонийные соли. Сам окислитель при этой реакции восстанавливается до металлического серебра. За тонкий серебряный налет на стенках пробирки, который образуется при этой реакции, реакция альдегидов с аммиачным раствором оксида серебра получила название реакции «серебряного зеркала». СН3-СН=O)+2OH->CH3COONH4+2Ag+3NH3+H2O. Альдегиды также восстанавливают свежеприготовленный аммиачный раствор гидроксида меди (II), обладающий светло-голубой окраской (реактив Фелинга), до желтого гидроксида меди (I), который при нагревании разлагается с выделением ярко-красного осадка оксида меди (I). СН3-СН=О + 2Cu(ОН)2 - СН3СООН+2CuОН+Н2О 2CuOH->Cu2O+H2O
2. Р. Присоединения
Гидрирование - присоединение водорода.
Карбонильные соединения восстанавливаются до спиртов водородом, алюмогидридом лития, боргидридом натрия. Водород присоединяется по связи C=O. Реакция идет труднее, чем гидрирование алкенов: требуется нагревание, высокое давление и металлический катализатор (Pt, Ni):
3. Взаимодействие с вод ой.
4. Взаимодействие, со спиртами.
При взаимодействии альдегидов со спиртами могут образовываться полуацетали и ацетали. Полуацетали представляют собой соединения, в которых при одном атоме углерода содержится гидроксильная и алкоксильная группа. К ацеталям относят вещества, в молекулах которых содержится атом углерода с двумя алкоксильными заместителями.
Ацетали, в отличие от альдегидов, более устойчивы к окислению. Благодаря обратимости взаимодействия со спиртами их часто используют в органическом синтезе для « защиты» альдегидной группы.
4.Присоединение гидросульфитов.
Гидросульфит NaHSO3 тоже присоединяется по связи C=O с образованием кристаллического производного, из которого карбонильное соединение может быть регенерировано. Бисульфитные производные используются для очистки альдегидов и кетонов.
В результате поликонденсации фенола с формальдегидом в присутствии катализаторов образуются фенолформальдегидные смолы, из которых получают пластмассы - фенопласты (бакелиты). Фенопласты - важнейшие заменители цветных и черных металлов во многих отраслях промышленности. Из них изготавливается большое количество изделий широкого потребления, электроизоляционные материалы и строительные детали. Фрагмент фенолформальдегидной смолы показан ниже:
Исходными соединениями для получения альдегидов и кетонов могут быть углеводороды, галогенопроизводные, спирты и кислоты.
Применение карбонильных соединений
Формальдегид используется для получения пластмасс, например бакелита, дубления кож, дезинфекции, протравливания семян. Совсем недавно в нашей стране разработан метод получения полиформальдегида (-СН2-О-)n, который обладает высокой химической и термической устойчивостью.
Это ценнейший конструкционный пластик, способный во многих случаях заменить металлы. Ацетальдегид используют для получения уксусной кислоты и некоторых пластмасс. Ацетон применяется как исходное вещество для синтеза многих соединений (например, метилметакрилата, полимеризацией которого получают оргстекло); он используется также в качестве растворителя.





















 Назад
Вперёд
Назад
Вперёд
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цель урока: характеризовать состав, строение, классификацию, физические и химические свойства, получение и применение альдегидов. Устанавливать взаимосвязь между изученными классами органических соединений. Знать качественные реакции на альдегиды.
Всюду в нашей жизни мы встречаемся с органической химией: мы едим продукты химической промышленности, мы одеваемся непосредственно в ее результаты: ацетатный шелк, искусственную шерсть, изделия из кожзаменителя и многое другое, благодаря химии мы можем проводить сложные операции (наркоз), лечить ангину и просто ставить уколы, где в качестве антисептика мы выбираем этиловый спирт.
Сегодня мы познакомимся с вами с классом органических веществ – альдегидами. Сегодня на уроке мы докажем, что жизнь без альдегидов невозможна. Узнаем, как связаны с этой темой хорошо известные вещества: ванилин, моющие средства, формалин, пластмасса, зеркало, уксусная кислота
Итак, альдегиды – это органические соединения, содержащие в составе своей молекулы, полярную карбонильную группу. В зависимости от заместителей, связанных с оксогруппой, эти вещества подразделяют на альдегиды и кетоны. В альдегидах с карбонильной группой связаны углеводородный радикал и атом водорода, тогда как в кетонах карбонильный углерод связан с двумя углеводородными радикалами.

Общая формула предельных карбонильных соединений C n H 2n O
Названия альдегидов по тривиальной номенклатуре часто производят от названий соответствующих монокарбоновых кислот. По рациональной номенклатуре альдегиды с разветвленной углеводородной цепью рассматриваются как производные ацетальдегида. По систематической номенклатуре названия рассматриваемых соединений производятся от соответствующих алканов с добавлением суффикса – аль.
Способы получения альдегидов. Основными способами получения альдегидов является каталитическое дегидрирование спиртов, гидратация алкинов, окисление спиртов.
Физические свойства.
Первый член гомологического ряда предельных альдегидов НСОН – бесцветный газ, несколько последующих альдегидов – жидкости. Высшие альдегиды – твердые вещества. Карбонильная группа обуславливает высокую реакционную способность альдегидов. Температура кипения альдегидов возрастает с увеличением молекулярной массы. Кипят они при более низкой температуре, чем соответствующие спирты, например пропионовый альдегид при 48,8 0 С, а пропиловый спирт – при 97,8 0 С.
Плотность альдегидов меньше единицы. Муравьиный и уксусный альдегиды хорошо растворяются в воде, последующие – хуже. Низшие альдегиды имеют резкий, неприятный запах, некоторые высшие – приятный запах.
Реакционная способность альдегидов обусловлена наличием активной карбонильной группы. Высокая электроотрицательность атома кислорода способствует сильной поляризации двойной связи в карбонильной группе и смещению подвижных?-электронов в сторону атома кислорода.

Химические свойства альдегидов:
1. Реакции присоединения:
А) реакция гидрирования
Б) реакция присоединения NaHSO 3
2. Реакции окисления:
А) реакция серебряного зеркала
Б) реакция светофор
3. Реакция поликонденсации
4. Реакция полимеризации
Качественная реакция на карбоксильную группу - реакция окисления альдегидов гидроксидом меди (ІІ) - светофор.
НСОН + 2Cu(OH) 2 = HCOOH +Cu 2 O +2H 2 O
“Реакция серебряного зеркала”
Вы можете представить себе жизнь без зеркала? Проснуться утром – и не увидеть своего отражения? Кажется, ерунда, мелочь. А ведь какой душевный дискомфорт! Недаром сказочных персонажей в качестве наказания лишали отражения. Что такое зеркало? В чем его сила? Откуда оно появилось? Как его изготавливают?
Как мы уже знаем, первыми настоящими зеркалами служили отполированные до блеска металлические пластинки из меди, золота, серебра. Однако такие зеркала имели большой недостаток – на воздухе быстро темнели и тускнели. Какой же выход нашли из этой ситуации? Многочисленные опыты показали, что блестящий металлический слой можно нанести и на стекло. Так, в I в. н.э. начали изготавливать стеклянные зеркала – стеклянные пластинки, соединенные со свинцовыми или оловянными пластинами. Делалось это так: мыли спиртом стекло, очищали его тальком и затем к поверхности плотно прижимали оловянный лист. Сверху наливали ртуть и, дав ей постоять, сливали избыток. Образовавшийся слой амальгамы заклеивали или закрашивали. Такие зеркала оказались намного долговечнее металлических, поэтому ремесленные мастерские перешли на выпуск стеклянных зеркал, отражающая поверхность которых была сделана из амальгамы олова (раствор олова Sn в ртути Hg). Но, поскольку пары ртути очень ядовиты, производство ртутных зеркал было весьма вредным, да и сами зеркала содержали ртуть. Было опасно держать ртутные зеркала в жилых помещениях.
Поэтому ученые продолжали искать замену для ртути. Ее нашли французский химик Франсуа Птижан и великий немецкий ученый Юстус Либих. Либих предложил изготавливать стеклянные зеркала с серебряным покрытием. Разработанный им метод состоял из следующих операций. Сначала к водному раствору нитрата серебра AgNO 3 добавляли водный раствор гидроксида калия KОН, что приводило к осаждению черно-коричневого осадка оксида серебра Ag 2 O.
2AgNO 3 + 2KOH = Ag 2 O + 2KNO 3 + H 2 O.
Осадок отфильтровывали и перемешивали с водным раствором аммиака NH 3 .
Ag 2 O + 4NH 3 + H 2 O = 2 (OH).)
Оксид серебра растворялся в аммиачной воде с образованием комплексного соединения (аммиаката, или аммина) – гидроксида диамминсеребра(I). Затем в полученный прозрачный раствор погружали лист стекла, одна из поверхностей которого была тщательно обезжирена, и добавляли формальдегид НСНО.
2(OH) + HCHO = 2Ag + HCOONH 4 + 3NH 3 + H 2 O.)
Формальдегид восстанавливал серебро, которое осаждалось на очищенной поверхности стекла, покрывая его блестящим зеркальным налетом.
Применение альдегидов и кетонов.
Формальдегид. Первым членом гомологического ряда предельных альдегидов является формальдегид НСОН. Его называю также метаналь и муравьиный альдегид. Он представляет собой бесцветный газ с характерным резким запахом. Широко применяется водный раствор, содержащий в массовых долях 0,4, или 40%, метаналя. Он называется формалином. Формальдегид (формалин), прозрачная бесцветная жидкость со своеобразным острым запахом. Применяют как дезинфицирующее и дезодорирующее средство для мытья рук, обмывания кожи при повышенной потливости (0,5–1%), для дезинфекции инструментов (0,5%), для спринцеваний (1:2000 – 1:3000). Входит в состав лизоформа.
Его использование основано также на свойстве свертывать белок. Так, например, в кожевенном производстве дубящее действие формалина объясняется свертыванием белка, в результате чего кожа твердеет и не подвергается гниению. На этом же свойстве основано применение формалина для сохранения биологических препаратов. Иногда формалин используется для дезинфекции и протравливания семян. Метаналь идет на производство некоторых лекарственных веществ и красителей. Большое количество метаналя используется для получения фенолформальдегидной смолы, которую получают при взаимодействии метаналя с фенолом. Эта смола необходима для производства различных пластмасс.

Пластмассы, изготовленные из фенолформальдегидной смолы в сочетании с различными наполнителями, называются фенопластами. При растворении фенолформальдегидной смолы в ацетоне или спирте получают различные лаки.
При взаимодействии метаналя с карбамидом СО(NН) 2 получают карбамидную смолу, а из нее – аминопласты. Из этих пластмасс изготовляют микропористые материалы для нужд электротехники (выключатели, розетки), материалы для отделки мебели и интерьеров, древесностружечные плиты, искусственный мрамор. Тепло – и звукоизоляционные пористые материалы.
Ацетальдегид СН 3 – СОН представляет собой бесцветную жидкость с резким удушающим запахом. Применяют в производстве ацетатов целлюлозы, уксусной и пероксиуксусной кислот, уксусного ангидрида, этилацетата, глиоксаля, алкиламинов, бутанола, хлораля. Подобно формальдегиду он вступает в реакции поликонденсации с аминами, фенолом и другими веществами, образуя синтетические смолы, широко применяемые в промышленности.
Бензальдегид С 6 Н 5 С(Н)=О с запахом горького миндаля содержится в миндальном масле и в эфирном масле эвкалипта. Синтетический бензальдегид используется в пищевых ароматических эссенциях и в парфюмерных композициях.
Алифатический альдегид СН 3 (СН 2) 7 С (Н)=О (тривиальное название – пеларгоновый альдегид) содержится в эфирных маслах цитрусовых растений, обладает запахом апельсина, его используют как пищевой ароматизатор.
Ароматический альдегид ванилин содержится в плодах тропического растения ванили, сейчас чаще используется синтетический ванилин – широко известная ароматизирующая добавка в кондитерские изделия.
Цитраль С 10 Н 15 О (3,7-диметил – 2,6-октадиеналь) с запахом лимона используется в средствах бытовой химии.
Кротоновый альдегид. Сильный лакриматор, используют для получения бутанола, сорбиновой и масляной кислот. Содержится в соевом масле. Применение альдегидов в медицине.
Коричный альдегид содержится в масле корицы, его получают перегонкой коры дерева корицы. Применяется в кулинарии в виде палочек или порошка
Уротропин (CH 2) 6 N 4 (гексаметилентетрамин), бесцветные кристаллы без запаха, легко растворимы в воде. Водные растворы имеют щелочную реакцию. Обладает антисептическим действием. Применяют главным образом при инфекционных процессах мочевыводящих путей (циститах, пиелитах). Действие основано на способности препарата разлагаться в кислой среде с образованием формальдегида. Назначают препарат натощак. Показаниями для его применения служат холециститы, холангиты, аллергические заболевания кожи, глаз (кератиты, иридоциклиты и др.). Препарат может вызвать раздражение паренхимы почек, при этих признаках прием препарата прекращают.
Акролеин. Используется для производства пластмасс, отличающихся большой твердостью. Акролеин и его натриевые соли являются эмульгаторами, структурирующими почвы, лактонные его производные улучшают свойства бумаги и текстильных изделий.
Обобщение и систематизация знаний. Подведение итогов урока.
Таким образом, способность альдегидов и кетонов участвовать в различных превращениях определила их основное применение в качестве исходных соединений для синтеза разнообразных органических веществ: спиртов, карбоновых кислот и их ангидридов, лекарственных препаратов (уротропин), полимерных продуктов (фенолоформальдегидные смолы, полиформальдегид), в производстве всевозможных душистых веществ (на основе бензальдегида) и красителей.
Домашнее задание.
Альдегиды и кетоны.
Альдегиды и кетоны имеют схожее химическое строение. Поэтому рассказ о них объединён в одной главе.
В строении обоих соединений прсутствует двухвалентная карбонильная группа:
Отличие альдегидов и кетонов следующее. В альдегидах карбонильная группа связана с одним атомом водорода и с углеводородным радикалом, в то время как в кетонах она связана с двумя углеводородными радикалами.

Химические свойства альдегидов и кетонов.
Наличие и в альдегидах и в кетонах карбонильной группы обуславливает определённое сходство их свойств. Однако имеются и различия. Это различие объясняется присутствием в молекуле альдегида атома водорода, связанного с карбонильной группой. (В молекуле кетонов подобный атом отсутствует).
Карбонильная группа и связанный с ней атом водорода, выделены в отдельную функциональную группу. Эта группа получила название альдегидной функциональной группы .

За счёт присутствия водорода в молекуле альдегида, последние легко окисляются (присоединяют кислород) и превращаются в карбоновые кислоты.
Например, при окислении уксусного альдегида образуется уксусная кислота:

Вследствии лёгкой окисляемости альдегиды являются энергичными восстановителями. Этим они существенно отличаются от кетонов, которые окисляются значительно труднее.
Получение альдегидов и кетонов.
Альдегиды и кетоны можно получить окислением соответствующих спиртов , имеющих тот же углеродный скелет и гидроксил при том же атоме углерода, который в получаемом альдегиде или кетоне образует карбонильную группу.
Если в качестве окисляемого спирта используется первичный спирт, то в результате окисления получится альдегид.
Муравьиный альдегид (формальдегид).
– это простейший альдегид с формулой:

Получают формальдегид из метилового спирта – простейшего из спиртов.
В формальдегиде в качестве радикала выступает атом водорода.
Свойства:
– это газ с резким неприятным запахом, хорошо растворимый в воде. Обладает антисептическими, а также дубящими свойствами.
Получение:
Получают формальдегид из метилового спирта путём каталитического окисления его кислородом воздуха или путём дегидрирования (отщеплением водорода).

Применение:
Водный раствор формальдегида (обычно 40%) называется формалином . Формалин широко прменяется для дизинфекции, консервирования анатомических препаратов. Значительные количества формальдегида используются для получения фенолформальдегидных смол.
Это один из наиболее важных альдегидов. Он соответствует этиловому спирту и может быть получен его окислением.

Уксусный альдегид широко встречается в природе и производится в больших количествах индустриально. Он присутствует в кофе, в спелых фруктах, хлебе, и синтезируется растениями как результат их метаболизма.
Свойства:
Уксусный альдегид – легко кипящая бесцветная жидкость (температура кипения 21 градуса С). Имеет характерный запах прелых яблок, хорошо растворим в воде.
Получение:
В прмышленности уксусный альдегид получается:
- окислением этилена,
- присоединением воды к ацетилену,
- окислением или дегидрированием этилового спирта.
Применение:
Применяют уксусный альдегид для получения уксусной кислоты, бутадиена, некоторых органических веществ, альдегидных полимеров.
Диметилкетон (ацетон).
Диметилкетон (ацетон ) является простейшим кетоном. В его молекуле роль углеводородных радикалов выполняет метил СН 3 (остаток метана).

Свойства:
Ацетон – бесцветная жидкость с характерным запахом.
Температура кипения 56,2 градуса С .
Ацетон смешивается с водой во всех соотношениях.
Является одним из метаболитов, производимых человеческим организмом.
Получение:
- Ацетон может быть получен окислением пропена,
- Используются методы получения ацетона из изопропилового спирта и ацетилена,
- Основную часть ацетона получают как сопродукт при получении фенола из бензола по кумольному способу.
Применение:
Ацетон – очень хороший растворитель многих органических веществ. Широко применяется в лакокрасочной промышленности, в производстве некоторых видов искусственного волокна, небъющегося органического стекла, киноплёнки, бездымного пороха. Ацетон также используется как исходное вещество для синтеза ряда органических соединений.
Общая формула кетонов: R 1 -CO-R 2 .
По номенклатуре ИЮПАК, названия кетонов образуют путем присоединения к названию соответствующих углеводородов суффикса "он" или к названию радикалов, связанных с кетогруппой С=О, слова "кетон"; при наличии старшей группы кетогруппу обозначают префиксом "оксо". Например, соединения СН 3 -СН 2 -СО-СН 2 -СН 2 -СН 3 называется 3-гексанон или этилпропилкетон, соединения СН 3 -СО-СН 2 -СН 2 -СООН - 4-оксопентановая кислота. Для некоторых кетонов приняты тривиальные названия.
Среди других карбонильных соединений наличие в кетонах именно двух атомов углерода, непосредственно связанных с карбонильной группой, отличает их от карбоновых кислот и их производных, а также альдегидов.
Особый класс циклических ненасыщенных дикетонов - хиноны.
Физические свойства
Простейшие кетоны являются бесцветными, летучими жидкостями, которые растворяются в воде. Кетоны обладают приятным запахом. Высшие кетоны - твердые, легкоплавкие вещества. Газообразных кетонов не бывает, так как уже простейший из них (ацетон) - жидкость. Многие химические свойства, характерные для альдегидов, проявляюся и у кетонов.
Кето-енольная таутомерия
Таутомерия - тип изомерии, при которой происходит быстрое самопроизвольное обратимое взаимопревращение структурных изомеров - таутомеров. Процесс взаимопревращения таутомеров называется таутомеризацией.
Кетоны, которые имеют по крайней мере один α-водородный атом, подвергаются кето-енольной таутомеризации.

Для оксосоединений, имеющих атом водорода в α-положении по отношннию к карбонильной группе, существует равновесие между таутомерными формами. Для подавляющего большинства оксосоединений это равновесие смещено в сторону кето-формы. Процесс перехода кето-формы в енольную называют енолизацией. На этом основана способность таких кетонов реагировать как С-или О-нуклеофилы. Концентрация енольной формы зависит от строения кетонов и составляет (в %): 0,0025 (ацетон), 2 (циклогексанон), 80 (ацетилацетон). Скорость енолизации возрастает в присутствии кислот и оснований.

Химические свойства
По степени окисленности кетоны, как и альдегиды, занимают промежуточное положение между спиртами и кислотами, что во многом определяет их химические свойства.
1. Кетоны восстанавливаются до вторичных спиртов гидридами металлов, например LiAlH 4 или NaBH 4 , водородом (кат. Ni, Pd), изопропанолом в присутствии алкоголята Аl (реакцияция Меервейна-Понндорфа-Верлея).
R 2 CO + 2H → R 2 CH(OH)
![]()
2. При восстановлении кетонов натрием или электрохимически (катодное восстановление) образуются пинаконы.
2R 2 CO + 2H → R 2 CH(OH)-CR 2 (OH)
3. При взаимодействии кетонов с амальгамированным Zn и концентрированной НCl (реакция Клемменсена) или с гидразином в щелочной среде (реакция Кижнера - Вольфа) группа С=О восстанавливается до СН 2 .
4. Окисление кетонов
В отличие от альдегидов, многие кетоны устойчивы при хранении к действию кислорода. Кетоны, содержащие α-метиленовую группу, окисляются SeO 2 до 1,2-дикетонов, более энергичными окислителями, напр. КМnО 4 - до смеси карбоновых кислот. Циклические кетоны при взаимодействии с HNO 3 или КМnО 4 подвергаются окислительному расщеплению цикла, например, из циклогексанона образуется адипиновая кислота. Линейные кетоны окисляются надкислотами до сложных эфиров, циклические - до лактонов (реакция Байера - Виллигера).

Если в качестве окислителя используют, например, хромовую смесь (смесь концентрированной серной кислоты и насыщенного раствора дихромата калия) при нагревании. Окисление кетонов всегда сопровождается разрывом углерод-углеродных связей, в результате образуется, в зависимости от строения исходного кетона, смесь кислот и кетонов с меньшим числом атомов углерода. Окисление протекает по схеме:

В первую очередь окисляется углерод в α-положении по отношению к карбонильной группе, как правило, наименее гидрогенизированный. Если кетон является метилкетоном, то одним из продуктов его окисления будет углекислый газ. Связь между соседними карбонильными углеродами легко рвется, в результате:

Окисление кетонов до карбоновых кислот не может происходить без расщепления углеродного скелета и требует более жестких условий, чем окисление альдегидов. А. Н. Попов, изучавший окисление кетонов, показал, что из несимметрично построенного кетона при окислении могут образоваться все четыре возможные карбоновые кислоты (правило Попова):

Если кетон содержит в α-положении третичный углеродный атом, то в результате окисления образуются три карбоновые кислоты и новый кетон, который в зависимости от условий может или подвергнуться дальнейшему окислению, или остаться неизмененным:

5. Альдольная и кретоновая конденсации
Кетоны образуют продукты замещения α-атомов Н при галогенировании действием Вr 2 , N-бромсукцинимидом, SO 2 Cl 2 , при тиилировании дисульфидами. При алкилировании и ацилировании енолятов кетонов образуются либо продукты замещения α-атомов Н в кетонах, либо О-производные енолов. Большое значение в органическом синтезе имеют альдольная и кретоновая конденсации, например:

При конденсации с альдегидами кетоны реагируют главным образом как СН-кислоты, например из кетонов и СН 2 О в присутствии основания получают α, β-ненасыщенные кетоны:
RCOCH 3 + СН 2 О → RCOCH=CH 2 + Н 2 О
Вследствие полярности карбонильной группы
кетоны могут вступать в реакции как С-электрофилы, например при конденсации с производными карбоновых кислот (конденсация Штоббе, реакция Дарзана и т. п.):
(CH 3) 2 CO + (C 2 H 5 OOCCH 2) 2 + (CH 3) 3 COK → (CH 3) 2 =C(COOC 2 H 5)CH 2 COOK + C 2 H 5 OH + (CH 3) 3 COH
Особенно легко нуклеофильной атаке подвергаются α,β-непределъные кетоны, но в этом случае атакуется двойная связь (раекция Михаэля) , например:
6. Взаимодействие с илидами
При взаимодействии с илидами Р (алкилиденфосфоранами) кетоны обменивают атом О на алкилиденовую группу (реакция Виттига) :
R 2 C=O + Ph 3 P=CHR" → R 2 C=CHR" + Ph 3 PO
7. С циклопентадиеном кетоны образуют фульвены, например:
8. При конденсации кетонов с гидроксиламином получаются кетоксимы R 2 C=NOH, с гидразином - гидразоны R 2 C=N-NH 2 и азины R 2 C=N-N=CR 2 , с первичными аминами - Шиффовы основания R 2 C=NR", со вторичными аминами - енамины.
9. Присоединение по карбонильной групе
Кетоны способны присоединять по карбонильной группе воду, спирты, бисульфит Na, амины и другие нуклеофилы, хотя эти реакции протекают не так легко, как в случае альдегидов.
Поскольку в спиртовых растворах равновесие между кетоном и его полукеталем сильно смещено влево, получить кетали из кетонов и спиртов трудно:
RCOR" + R"OH ↔ RR"C(OH)OR"
Для этой цели используют реакцию кетонов с эфирами ортомуравьиной кислоты. Кетоны взаимодействуют с С-нуклеофилами, например с литий-, цинк- или магнийорганические соединения, а также с ацетиленами в присутствии оснований (реакция Фаворского) , образуя третичные спирты:

В присутствии оснований к кетонам присоединяется HCN, давая α-гидроксинитрилы (циангидрины):
R 2 C=O + HCN → R 2 C(OH)CN
При катализе кислотами кетоны реагируют как С-электрофилы с ароматическими соединениями, например:
Гомолитическое присоединение кетонов к олефинам приводит к α-алкилзамещенным кетонам, фотоциклoприсоединение к оксетанам, например:

Получение кетонов
1. Окисление спиртов
Кетоны могут быть получены окислением вторичных спиртов. Окислителем, обычно применяемым для этой цели в лабораториях, является хромовая кислота, употребляемая чаще всего в виде «хромовой смеси» (смесь бихромата калия или натрия с серной кислотой). Иногда применяются также перманганаты различных металлов или перекись марганца и серная кислота.
2. Дегидрогенизация (дегидрирование) вторичных спиртов
При пропускании паров спирта через нагретые трубки с мелко раздробленной, восстановленной водородом металлической медью вторичные спирты распадаются - на кетон и водород. Несколько хуже эта реакция проходит в присутствии никеля, железа или цинка.
3. Из одноосновных карбоновых кислот
Кетоны могут быть получены сухой перегонкой кальциевых и бариевых солей одноосновных кислот. Для всех кислот, кроме муравьиной, реакция идет следующим образом:
Чаще восстанавливают не самые кислоты, а их производные, например хлорангидриды:
CH 3 -CO-Cl + 2H → CH 3 -CHO + HCl
т. е. образуется кетон с двумя одинаковыми радикалами и карбонат кальция.
Если взять смесь солей двух кислот или смешанную соль, то наряду с предыдущей реакцией происходит также реакция между молекулами разных солей:
Вместо сухой перегонки готовых солей используют также контактный способ, так называемую реакцию кетонизации кислот, состоящую в том, что пары кислот пропускают при повышенной температуре над катализаторами, в качестве которых применяют углекислые соли кальция или бария, закись марганца, окись тория, окись алюминия и др.
Здесь сначала образуются соли органических кислот, которые затем разлагаются, регенерируя вещества, являющиеся катализаторами. В результате реакция идет, например, для уксусной кислоты по следующему уравнению:
2CH 3 -COOH → CH 3 -CO-CH 3 + H 2 O + CO 2
4. Действие воды на дигалоидные соединения
Кетоны могут получаться при взаимодействии с водой дигалоидных соединений, содержащих оба атома галоида при одном и том же атоме углерода. При этом можно было бы ожидать обмена атомов галоида на гидроксилы и получения двухатомных спиртов, у которых обе гидроксильные группы находятся при одном и том же атоме углерода, например:
Но такие двухатомные спирты в обычных условиях не существуют, они отщепляют молекулу воды, образуя кетоны:

5. Действие воды на ацетиленовые углеводороды (реакция Кучерова)
При действии воды на гомологи ацетилена в присутствии солей окиси ртути, получаются кетоны:
CH 3 -C≡CH + H 2 O → CH 3 -CO-CH 3
6. Получение с помощью магний- и цинкорганических соединений
При взаимодействии производных карбоновых кислот с некоторыми металлоорганическими соединениями присоединение одной молекулы металлоорганического соединения по карбонильной группе протекает по схеме:
Если на полученные соединения подействовать водой, то они реагируют с ней с образованием в кетонов:
При действии на амид кислоты двух молекул магнийорганического соединения, а затем воды получаются кетоны без образования третичных спиртов:

7. Действие кадмийорганических соединений на хлорангидриды кислот
Кадмийорганические соединения взаимодействуют с хлорангидридами кислот иначе, чем магний- или цинкорганические:
R-CO-Cl + C 2 H 5 CdBr → R-CO-C 2 Н 5 + CdClBr
Поскольку кадмийорганические соединения не вступают в реакцию с кетонами, здесь не могут получаться третичные спирты.
Применение кетонов
В промышленности кетоны используют как растворители, фармацевтические препараты и для изготовления различных полимеров. Важнейшими кетонами являются ацетон, метилэтиловый кетон и циклогексанон.
Физиологическое действие
Токсичны. Обладают раздражающим и местным действием, проникают через кожу, особенно хорошо ненасыщенные алифатические. Отдельные вещества обладают канцерогенным и мутагенным эффектом. Галогенпроизводные кетонов вызывают сильное раздражение слизистых оболочек и ожоги при контакте с кожей. Алициклические кетоны обладают наркотическим действием.
Кетоны играют важную роль в метаболизме веществ в живых организмах. Так, убихинон участвует в окислительно-восстановительных реакциях тканевого дыхания. К соединениям, содержащим кетонную группу, относятся некоторые важные моносахариды (фруктоза и др.), терпены (ментон, карвон), компоненты эфирных масел (камфора, жасмон), природные красители (индиго, ализарин, флавоны), стероидные гормоны (кортизон, прогестерон), мускус (мускон), антибиотик тетрациклин.
В процессе фотосинтеза 1,5-дифосфат-D-эритро-пентулозы (фосфолированная кетопентоза) является катализатором. Ацетоуксусная кислота - промежуточный продукт в цикле Креббса.
Наличие в моче и крови человека кетонов говорит о гипогликемии, различных расстройствах метаболизма или кетоацидозе.
Популярное
- Раздел презентации на тему твардовский
- Самые дельные советы по изучению английского языка самостоятельно Как учить алфавит
- Концепция подражания г, тарда Габриэль Тард и его социальная теория
- Человек разумный (homo sapiens)
- Как развить в себе магические способности
- Краткая биография и дети Чингисхана
- Первый ледокол ермак. Ледокол ермак. Долгая служба ледокола «Ермак»
- Француженок, которые "водились" с немцами брили наголо (11 фото)
- Необходимый перечень документов на лицензию образовательной деятельности
- Расцвет империи моголов. Загадочный падишах. акбар великий Религиозная реформа Акбара